- Traitement de la maladie de Waldenström
- A. Maladies de Waldenström asymptomatiques ou indolentes
- B. Maladies de Waldenström symptomatiques
- 1. Plasmaphérèse
- 2. Traitement de 1ère ligne
- A. Référentiel SFH (Société française d’hématologie) 2009
- C. How I Treat Waldenström macroglobulinemia, Steven P. Treon, 17 september 2009 (Volume 114, N. 12)é
Traitement de la maladie de Waldenström
| En résumé, le traitement de la maladie de Waldenström en 2010… Pas de consensus sur la prise en charge… Certaines tendances… |
1ère ligne :
2ème ligne et + Le choix du traitement de rattrapage dépend de la première ligne utilisée, de la qualité de réponse et de la durée de réponse ainsi que d’autres données telles que l’âge, la tolérance du traitement initial, la possibilité de réaliser une autogreffe. |
A. Maladies de Waldenström asymptomatiques ou indolentes
Tableau : Maladie de Waldenström asymptomatique, indications de surveillance
| Hémoglobine > 10 g/dL Plaquettes > 100 000/mm3 Pas de syndrome tumoral important Pas de sd d’hyperviscosité |
Abstention & surveillance
Surveillance clinique et biologique |
Les patients asymptomatiques doivent être simplement surveillés quelque soit la valeur du pic monoclonal.
Le taux d’IgM doit être impérativement mesuré sur l’électrophorèse des protides et non sur la technique de dosage pondéral de l’IgM par néphélémétrie.
Si le pic est supérieur à 50 g/L (ou la protidémie > 100 g/L), une prudence particulière s’impose, le risque de syndrome d’hyperviscosité étant plus important.
Bien rechercher des signes d’hyperviscosité (saignement oronasal, vision trouble, céphalées, vertiges…). Le fond d’oeil s’impose !
Semin Oncol 30:206-210, 2003 – 31 patients
Temps moyen jusqu’à progression de la maladie : 6.9 ans
Facteurs prédictifs de progression :
- hémoglobine < 11.5
- ?2-microglobuline ? 3 mg/dl
- protéine monoclonale > 30 g/L
Temps jusqu’à progression : 10 ans si 0 facteurs, 2 ans si 1, 0.5 an si 2 ou +
Taux de réponse et survie après instauration du traitement similaires dans les 3 groupes
B. Maladies de Waldenström symptomatiques
Si les indications du traitement des maladies de Waldenström sont aujourd’hui consensuelles (cf tableau ci-dessous), leur traitement est actuellement sujet à discussion selon les équipes. Les corticoïdes puis le chlorambucil ou d’autres agents alkylants comme l’endoxan ont été les premiers traitements proposés mais l’avènement des analogues des purines (la fludarabine en tête) puis des molécules plus récentes telles que l’anticorps anti-CD20 (rituximab) ou l’inhibiteur du protéasome (Bortézomib) ont changé la donne. Quelle est, en 2010, le traitement de référence de la maladie de Waldenström ?
Critères de traitement d’une Maladie de Waldenström
| Cytopénies : hémoglobine < 10 g/dl, thrombopénie < 100000/mm3 Syndrome tumoral symptomatique (« bulky » disease) Hyperviscosité symptomatique Neuropathie sévère Amylose Cryoglobulinémie symptomatique Maladie des agglutinines froides Transformation en lymphome de haut grade |
Si le chlorambucil semble aujourd’hui ne pouvoir être proposé qu’aux patients dits (en bon franglais) « unfit » ou « fragiles » (patients âgés voire très âgés pour certains…) du fait des effets secondaires à long terme bien connus (risque de myélodysplasie, leucémie aiguë, difficultés à recueillir des cellules souches périphériques dans l’optique d’une autogreffe etc…), la fludarabine, prometteuse en terme de réponse et d’augmentation de survie sans progression, est également responsable d’effets secondaires du même type (cf. Leleu X. et al. J Clin Oncol 2009 : 12/193 soient 6.2% de patients ayant reçu un analogue nucléosidique ont développé une MDS/LAM ou une transformation en lymphome de haut grade vs 3/136 soient 1.6 % chez des patients traités sans analogues nucléosidiques).
De plus, on voit fleurir de plus en plus d’études proposant des combinaisons de ces différents agents dès la première ligne semblant donner des réponses au moins aussi bonnes (et souvent meilleures) qu’en monothérapie. Malheureusement, nous ne disposons pas d’études randomisées permettant de proposer un « gold standard ».
Quant aux traitements de rattrapage, on imagine aisément les multiples possibilités proposées (réutilisation de la première ligne, autres combinaisons). Le traitement standard de la maladie de Waldenström reste donc à déterminer en particulier pour la première ligne…
NB : les traitements et la démarche thérapeutique décrits dans la suite de cet article n’engagent que leur auteur. Ils sont le reflet de l’état actuel (avril 2010) de certaines données scientifiques publiées. Si vous êtes un patient, nous vous conseillons de discuter avec votre hématologue de votre traitement, chaque décision devant être en connaissance du dossier lors des réunions de concertations pluridisciplinaires (RCP).
1. Plasmaphérèse
- Pour les patients présentant une complication liée à l’immunoglobuline monoclonale, en particulier l’hyperviscosité
- Permet une réduction rapide du taux d’IgM de 30 à 60% en 2 à 3 séances
- 1 échange du volume plasmatique complet (soit environ 60 ml/kg) par séance avec substitution par albumine 4% (2/3) + macromolécules (1/3)
- Si besoin de transfusion globulaire, en fin de ou après la plasmaphérèse (éviter d’aggraver l’hyperviscosité)
En cas d’hyperviscosité, le patient est également hémodilué et présente le plus souvent une fausse anémie.
Ne pas transfuser sur le simple chiffre d’hémoglobine. Aux urgences, demander l’avis de l’hématologue
- également utilisée dans d’autres indications telles que les neuropathies périphériques et les cryoglobulinémies
2. Traitement de 1ère ligne
Pas de consensus faute d’études randomisées suffisantes. Ici sont présentées les recommandations de la SFH (société française d’hématologie) et celles récentes publiées.
Il n’y a donc pas de traitement type et il faut prendre en compte l’âge du patient, les cytopénies, le caractère symptomatique ou non de la maladie ou encore la nécessité d’avoir un rapide contrôle de la maladie ou non pour choisir le traitement adéquat.
A. Référentiel SFH (Société française d’hématologie) 2009
| Monothérapies | |||
| Chloraminophène | schéma continu 0,1 mg/kg/j schéma séquentiel 0,7 mg/kg/j pendant 7 jours toutes les 6 semaines durée maximale de traitement : 18 mois Remarque : l’adjonction de corticoïdes n’apporte rien |
Réponse lente (3-6 mois) Les 2 schémas sont comparables Réponse : 50-70% |
Kyle R, Greipp P, Gertz M, et al. Br J Haematol 2000 Même efficacité des deux schémas de traitement médiane de survie : 5,4 ans |
| Analogues des purines |
Fludarabine IV 25 mg/m2 J1-J5 ou Fludarabine per os (Fludara© cp 10 mg) 40 mg/m2 J1-J5 toutes les 4 semaines |
Réponse : 38-80% Durée : 13-36 mois |
Risque accru de leucémie aiguë ou de myélodysplasie voire de transformation Leleu X. et al. J Clin Oncol 2009 |
| Anticorps monoclonaux | Rituximab (Mabthera©) 375 mg/m2 | Réponse : 30-50% Durée : 7-27 mois |
Attention à l’effet flare (remontée transitoire du composant monoclonal surtout en monothérapie) |
| Bortezomib | Velcade© | Réponse : 30% Durée : 10 mois |
Attention à la toxicité neurologique |
| Associations | |||
| FC | Fludarabine p.o. 40 mg/m2 J1-J3 Cyclophosphamide p.o. 250 mg/m2 J1-J3 Toutes les 4 semaines |
Réponse : 55-88% Durée : 13-36 mois |
|
| RFC | Rituximab 375 mg/m2 J1 Fludarabine p.o. 40 mg/m2 J1-J3 Cyclophosphamide p.o. 250 mg/m2 J1-J3 Toutes les 4 semaines |
Réponse : 78-94% Durée estimée : 12-51 mois |
|
| RCD | Rituximab 375 mg/m2 IV J1 Cyclphosphamide 100 mg/m2 x 2/J PO J1-J5 Dexamethasone 20 mg IV J1 |
Réponse : 83% PFS 2 ans :67% OS 2 ans : 90% |
Dimopoulos MA, Anagnostopoulos A, et al. J Clin Oncol. 2007 Aug 1;25(22):3344-9 |
| R + Bendamustine | Rituximab 375 mg/m2 J1 Bendamustine 90 mg/m2 J1-J2 (vs R CHOP) |
Réponse : 96% (vs 94%)
tolérance Benda > CHOP |
Rummel MJ, von Gruenhagen U, Niederle N, et al. Bendamustine plus rituximab versus CHOP plus rituximab in the firstline treatment of patients with follicular, indolent and mantle cell lymphomas: results of a randomized phase III study of the Study Group Indolent Lymphomas (StiL). Blood. 2008;112(11, Abstract 2596 |
| BDR | Bortezomib Dexamethasone 40 mg Rituximab |
En cours d’évaluation au moment de la rédaction du référentiel (voir plus bas) | |
Conclusion du référentiel SFH : « En dehors des essais contro?le?s, indispensables pour une meilleure compre?hension de la maladie et de sa prise en charge, le choix the?rapeutique se porte de plus en plus sur les associations. L?association rituximab + chimiothe?rapie augmente le taux de re?ponse globale et la dure?e de re?ponse dans des essais non randomise?s et est recommande?e en premie?re ligne. »
B. Update on treatment recommandations from the fourth International Workshop on Waldenström’s Macroglobulinemia, JCO Jan 2009 (Volume 27, Number 1)
| Circonstances | Traitement recommandé |
| Candadidats à la transplantation | |
| Cytopénies | DRC, Rituixmab + Thalidomide |
| Composant monoclonal important | R-CHOP, DRC |
| Non candidat à la transplantation | |
| Cytopénies | DRC Rituximab + Thalidomide |
| Composant monoclonal important | Analogue des purines + Rituximab analogue des purines + Rituximab + cyclphosphasmide |
| Comorbidités importantes | |
| Composant monoclonal faible et cytopénies | Rituximab |
| Patient âgé et progression lente | Chloraminophène |
Autres thérapeutiques disponibles :
- Bortezomib (+/- Dexamethasone, Rituximab) : BDR, choix idéal en cas d’hyperviscosité & en seconde ligne… en attendant plus de données et des études…
- Alemtuzumab : toxicité importante au niveau infectieux (réactivation CMV…), « raisonnable » en troisième ligne thérapeutique
- Les greffes (auto et allo) : leur place reste à définir dans la stratégie thérapeutique (auto pour les patients jeunes avec IPSSWM haut risque ???)
- Chimiothérapie haute dose et autogreffe : TRM 8%, PFS 5 ans 33% et OS 5 ans : 61% (EBMT Registry)
- Allogreffe : NRM (non relapse mortality) 1 an : 27% – PFS 5 ans : 48%, OS : 63%
C. How I Treat Waldenström macroglobulinemia, Steven P. Treon, 17 september 2009 (Volume 114, N. 12)é
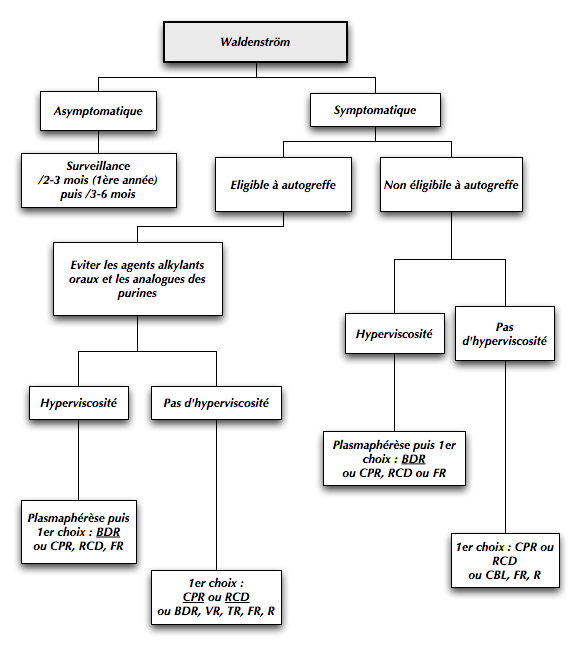 légende : BDR (Bortezomib, Dexamethasone, Rituximab), CPR (Cyclophosphamide, Prednisone, Rituximab),
légende : BDR (Bortezomib, Dexamethasone, Rituximab), CPR (Cyclophosphamide, Prednisone, Rituximab),
RCD (Rituximab, Cyclophosphamide, Dexamethasone), FR (Fludarabine, Rituximab),
VR (Velcade, Rituximab), R (Rituximab), CBL (Chloraminophène)
| BDR | Bortezomib + Dexamethasone + Rituximab Bortezomib 1,3 mg/m2 J1, J4, J8, J11 Dexamethasone 40 mg J1, J4, J8, J11 Rituximab 375 mg/m2 J11 + – |
| CPR
RCD |
Cyclophosphamide + Prednisone + Rituximab
Rituximab + Cyclophosphamide + Dexamethasone Associations à privilégier chez les patients éligibles à l’autogreffe et < 70 ans Réponse : 70-80% (identiques à aux associations analogues des purines et rituximab) Résultats identiques au R-CHOP et au R-CVP Attention à l’effet flare au rituximab => introduction du rituximab après 1 ou 2 cycles de chimiothérapie seule si pic important |
| FR | Fludarabine + Rituximab Fludarabine p.o. 25 mg/m2 J1-J5 toutes les 4 semaines – 4 à 6 cycles Alternative : J1-J4 toutes les 4 semaines, 4 cycles (moins toxique)** + Rituximab 375 mg/m2 toutes les 4 semaines (attention à l’effet flare) Réponse : 70-96% – PFS : 51.2 mois **myélosuppression importante à la dose usuelle de 25 mg/m2 p.o. pendant 5 jours avec 6 cycles mensuels |
| TR | Thalidomide + Rituximab
Chez les patients très cytopéniques et qui ne nécessitent pas une réponse rapide Neuropathie (grade 2 : 40%) => petite dose de thalidomide (100 mg/j) (Revlimid : toxicité hématologique importante) |
| VR | Bortezomib (Velcade) + Rituximab |
| R | Rituximab en monothérapie attention à l’effet flare (jusqu’à 40-50% des cas) pour les patients avec faible masse tumorale et cytopénies ou complications immunologiques (agglutinines froides, neuropathie…) ORR : 20-40% après 4 perfusions hebdomadaires (375 mg/m2) (S1, S2, S3 et S4) |
| CBL | Chorambucil |
- En cas de neuropathie périphérique : Rituximab ou CPR/RCD (2ème ligne : Bortezomib ou Thalidomide mais risque de neuropathie iatrogène)
- Entretien par rituximab non validé par une étude randomisée, certaines équipes proposant un entretien par Rituximab 375 mg/m2 tous les 3 mois pendant 2 ans (schéma inspiré du traitement des lymphomes folliculaires)
